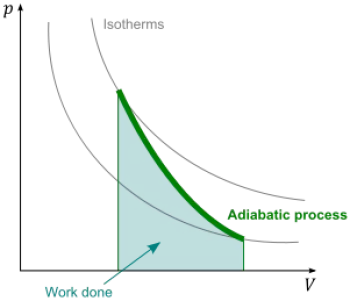
S'anomena procés adiabàtic un procés termodinàmic en què un sistema no intercanvia calor amb el seu entorn. Això implica que la calor que entra o surt del sistema és nul, és a dir, la variació d'energia interna del sistema es deu únicament a la feina feta sobre ell o per ell.
El terme "adiabàtic" fa referència a aquells elements o condicions que impedeixen l'intercanvi de calor amb l'entorn, com ara una paret adiabàtica que no permet la transferència de calor.
La suposició que un procés és adiabàtic s'utilitza sovint com una aproximació simplificadora en moltes anàlisis termodinàmiques, ja que facilita els càlculs. No obstant això, a la pràctica, no hi ha sistemes perfectament adiabàtics, encara que s'hi pot aproximar en molts casos.
El concepte de procés adiabàtic és fonamental per entendre i aplicar la primera llei de la termodinàmica, ja que estableix la relació entre la calor, el treball i lenergia interna dun sistema en absència de transferència de calor.
Exemples de processos adiabàtics
A continuació et presento alguns exemples de processos adiabàtics en diferents sistemes termodinàmics:
Expansió i compressió en un cilindre amb gas
 En un motor de combustió interna, la barreja d'aire i combustible es comprimeix adiabàticament quan el pistó es mou cap amunt al cilindre.
En un motor de combustió interna, la barreja d'aire i combustible es comprimeix adiabàticament quan el pistó es mou cap amunt al cilindre.
Aquest procés de compressió augmenta la temperatura del gas a causa de la compressió ràpida i sense pèrdua de calor cap a lentorn. Al final del cicle, quan el pistó es mou cap avall, el gas s'expandeix adiabàticament, fent feina sobre el pistó sense que es produeixi un intercanvi de calor amb l'entorn.
Flux de gas a través d'una tovera (broquet de Laval)
En un motor a reacció, els gasos d'escapament s'acceleren en passar per una tovera, cosa que provoca una expansió adiabàtica.
Durant aquest procés, el gas s'expandeix ràpidament, augmentant-ne el volum i reduint-ne la pressió, sense intercanviar calor amb l'entorn. L'energia interna del gas es converteix en energia cinètica, cosa que permet que el gas acceleri a altes velocitats, generant l'empenta necessària per propulsar l'avió.
Descens d'aire a l'atmosfera (escalfament adiabàtic)
Quan una massa d'aire baixa a l'atmosfera, com passa en fenòmens meteorològics com el foehn o el chinook, l'aire es comprimeix adiabàticament.
Aquest procés provoca que la temperatura de lʻaire augmenti sense que hi hagi transferència de calor des de lʻentorn.
Aquest tipus d'escalfament contribueix a la formació de vents càlids que afecten regions muntanyoses i en la previsió de fenòmens climàtics.
Refrigeradors i sistemes d'aire condicionat
En un sistema de refrigeració, com ara l'aire condicionat, el gas refrigerant experimenta una expansió adiabàtica en passar per la vàlvula d'expansió.
En aquest procés, la pressió i la temperatura del gas disminueixen ràpidament sense intercanviar calor amb lentorn.
Producció de so en gasos
Les ones sonores viatgen a través de l'aire mitjançant processos adiabàtics. A mesura que l'ona de so es propaga, les partícules de l'aire es comprimeixen i expandeixen ràpidament, sense temps perquè passi un intercanvi significatiu de calor.
Expansió d'un globus d'heli
En alliberar un gas d'heli en un globus, el gas s'expandeix adiabàticament. Si el globus s'enfila a l'atmosfera, l'heli s'expandeix sense intercanviar calor amb l'entorn, ja que el procés és molt ràpid.
L'expansió adiabàtica de l'heli al globus redueix la seva pressió i temperatura, cosa que li permet pujar.
Compressió d´aire en un compressor d´aire
En un compressor dʻaire, lʻaire és comprimit adiabàticament quan sʻintrodueix en un volum més petit. Aquest procés eleva la temperatura de l'aire sense permetre que la calor es dissipi a l'ambient, cosa que fa que l'aire s'escalfi considerablement.
L'energia que s'utilitza per comprimir l'aire augmenta la seva energia interna, cosa que es pot utilitzar més tard en aplicacions com l'acció d'eines pneumàtiques o sistemes de refrigeració.
Pistó en un motor Stirling
 En un motor Stirling, el gas dins dels cilindres s'expandeix adiabàticament durant la fase de treball. A mesura que el gas s'expandeix, es fa feina sobre el pistó, però no s'intercanvia calor amb l'entorn.
En un motor Stirling, el gas dins dels cilindres s'expandeix adiabàticament durant la fase de treball. A mesura que el gas s'expandeix, es fa feina sobre el pistó, però no s'intercanvia calor amb l'entorn.
Aquest tipus de motor aprofita les variacions de temperatura en un cicle adiabàtic per generar energia de manera eficient, encara que calen mecanismes addicionals per a l'intercanvi de calor en altres fases del cicle.
Conceptes relacionats
-
Un procés isentròpic és un procés adiabàtic que a més és reversible. En aquest cas, el sistema també manté constant l'entropia, cosa que el converteix en un procés ideal per a diverses aplicacions en enginyeria.
-
Una paret adiabàtica és la que no permet la transferència de calor entre el sistema i el seu entorn. A la pràctica, una paret aïllada es pot aproximar a les condicions d'una paret adiabàtica, encara que no de manera perfecta.
-
Un sistema adiabàtic és el que no permet l'intercanvi de calor amb l'exterior. Aquest concepte és clau en la modelització de diversos processos termodinàmics i és utilitzat comunament en l'enginyeria i la física.
Escalfament i refredament adiabàtic
La compressió adiabàtica dun gas provoca un augment en la temperatura. També augmenta lenergia interna del gas. L'expansió adiabàtica causa una baixada a la temperatura.
En tots dos processos l'energia del sistema roman constant. No hi ha ni increment ni pèrdua de calor. Per contra, l'expansió lliure és un procés isotèrmic per a un gas ideal.
Aquests canvis de temperatura es poden quantificar utilitzant:
- La llei dels gasos ideals.
- L'equació hidrostàtica per als processos atmosfèrics.
L'escalfament adiabàtic passa quan la pressió d'un gas augmenta a causa de la feina feta sobre ella pel seu entorn.
El refredament adiabàtic passa quan la pressió sobre un sistema adiabàticament aïllat disminueix. Aquesta disminució permet que s'expandeixi. En augmentar el volum, baixa la temperatura i la seva energia interna.