En termodinàmica, un procés isobàric és un canvi en l'estat d'una certa quantitat de matèria en què la pressió roman constant. El que sí que canvia és una o més de les variables d'estat, com ara el volum i la temperatura. Si es transfereix calor al sistema, es fa feina i també canvia l'energia interna del sistema.
El procés isobàric per a gasos ideals segueix la llei de Charles. Segons aquesta llei, per a una massa fixa de gas ideal a pressió constant, el volum és directament proporcional a la temperatura a Kelvin.
Els processos isobàrics es regeixen per la primera llei de la termodinàmica. En aquests processos, l'increment de l'entalpia (ΔH) és igual a la calor transferida al sistema, i el treball realitzat és P·ΔV. La relació entre l'energia interna, el treball i la calor s'expressa com a ΔU=Q−PΔV, i Q=ΔH.
Definició d´un procés isobàric
Un procés isobàric és aquell en què la pressió es manté constant mentre el sistema experimenta altres canvis. En termes més tècnics, es diu que la derivada de la pressió respecte al temps és igual a zero, és a dir:
dP/dt=0
Aquest tipus de procés es diferencia d'altres processos termodinàmics, com els processos isocòrics (en què el volum és constant), els processos isotèrmics (en què la temperatura és constant) i els processos adiabàtics (en què no hi ha transferència de calor ).
Tot i que la pressió es manté constant, altres propietats del sistema, com ara el volum i la temperatura, poden canviar. A mesura que el volum del sistema canvia, es fa treball, i aquest treball està relacionat amb la variació de volum sota una pressió constant.
Exemples de processos isobàrics
Per comprendre millor aquest procés termodinàmic ens ajudarà a veure un parell d'exemples.
-
Fase dexpansió del cilindre dun motor.
-
Ebullició daigua en un recipient obert.
-
Escalfament dun globus per efectes de la radiació solar.
Escalfament de l'aire d'un globus
El canvi de volum que experimenta un globus conforme els raigs del sol incideixen sobre ell és un exemple de procés isobàric.
A l'inici del matí presenta certa pressió, volum i temperatura, a mesura que s'escalfa l'aire a l'interior augmenta la pressió, però aquesta no varia degut a l'augment del volum.
Fase dexpansió del cilindre dun motor tèrmic
L'expansió d'aire en un cilindre amb un pistó movible al qual se subministra calor es fa mitjançant un procés isobàric.
El volum augmentarà de manera proporcional a la seva temperatura i la pressió es mantindrà constant. Això aprova la llei de Charles.
Ebullició d'aigua en un recipient obert
Un exemple quotidià dun procés isobàric es presenta en bullir aigua en un recipient obert. En subministrar energia calorífica a l'aigua, puja de temperatura i es converteix en vapor.
El vapor que s'obté té una temperatura superior i ocupa un volum més gran, però la pressió es manté constant. Des de l'inici, la pressió és igual a la pressió atmosfèrica.
Llei dels gasos ideals i processos isobàrics
Per entendre completament els processos isobàrics, és útil considerar l' equació d'estat dels gasos ideals , que estableix una relació entre la pressió (P), el volum (V), la temperatura (T) i la quantitat de gas (n) a mols, segons l'equació:
P·V=n·R·T
On R és la constant dels gasos ideals. En un procés isobàric, la pressió P és constant; això implica que, sota condicions de pressió constant, el volum d'un gas ideal és directament proporcional a la temperatura.
Si la temperatura d'un gas augmenta en un procés isobàric, el volum també augmenta proporcionalment, i si la temperatura disminueix, el volum es reduirà.
Aquesta relació és una forma de la llei de Charles, que és un cas particular de la llei dels gasos ideals per a un procés isobàric.
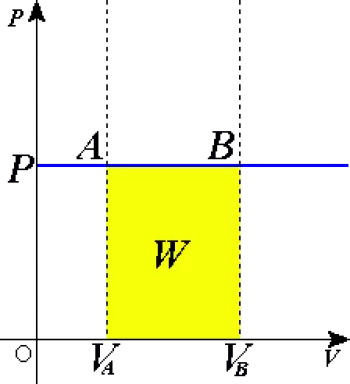
Treball realitzat en un procés isobàric
 Un dels aspectes més importants dels processos isobàrics és la feina feta per o sobre el sistema durant el procés.
Un dels aspectes més importants dels processos isobàrics és la feina feta per o sobre el sistema durant el procés.
En un procés termodinàmic, el treball realitzat pel sistema es defineix com:
W=∫P·dV
En un procés isobàric, on la pressió és constant, aquesta equació se simplifica a:
W=P·ΔV
On ΔV és el canvi en el volum del sistema. Si el volum augmenta, el sistema fa treball sobre el seu entorn, cosa que significa que el gas s'està expandint. Si el volum disminueix, l'entorn fa feina sobre el sistema, comprimint el gas.
Aquest treball realitzat està estretament vinculat al canvi en l'energia interna i la calor afegida o retirada del sistema, segons la segona llei de la termodinàmica, que estableix:
ΔU=Q−W
On:
- ΔU és el canvi a l'energia interna del sistema.
- Q és la calor afegida al sistema.
- W és la feina feta pel sistema.
En un procés isobàric, la calor afegida al sistema no només canvia l'energia interna del sistema, sinó que també es converteix en feina a causa del canvi en el volum. Aquesta característica és diferent d'un procés isocòric, on tota la calor afegida es converteix en energia interna, ja que no es realitza treball en un sistema de volum constant.